Etat des lieux de la prise en charge par chirurgie bariatrique en dialyse péritonéale
DOI :
https://doi.org/10.25796/bdd.v8i4.87096Mots-clés :
dialyse péritonéale, chirurgie bariatrique, obésitéRésumé
L’obésité constitue un enjeu majeur de santé publique et touche une proportion significative de patients atteints d’insuffisance rénale chronique terminale (IRCT). Chez les patients en dialyse péritonéale (DP), elle complique la prise en charge en augmentant le risque de complications mécaniques, d’infections, et en réduisant l’efficacité des échanges péritonéaux. Par ailleurs, l’obésité limite l’accès à la transplantation rénale, faisant de la perte pondérale un objectif crucial. La chirurgie bariatrique émerge comme une stratégie efficace pour améliorer la condition métabolique et favoriser l’inscription sur liste d’attente de greffe.
La sleeve gastrectomy (SG) est désormais la technique privilégiée chez les patients obèses en IRCT, notamment en raison d’un profil de sécurité favorable, d’un temps opératoire réduit et de l’absence de dérivation intestinale, limitant ainsi le risque de carences. Les données disponibles, bien que limitées à des séries de cas et rapports isolés, suggèrent que la SG peut être réalisée chez des patients en DP, soit avec reprise précoce de la DP, soit après une transition temporaire vers l’hémodialyse selon le statut clinique. Les protocoles optimisés incluent une reprise progressive de la DP à faibles volumes, permettant de minimiser les risques de fuite ou d’infection.
La chirurgie bariatrique apparaît ainsi faisable et globalement sûre chez les patients en DP, à condition d’une évaluation multidisciplinaire rigoureuse et d’un suivi nutritionnel étroit pour prévenir la dénutrition et la sarcopénie. Elle constitue une option thérapeutique pertinente pour améliorer l’accès à la transplantation rénale et optimiser le pronostic des patients obèses en insuffisance rénale terminale. Cet article a été rédigé suite à une présentation à la SFNDT (Société Francophone de Néphrologie, Dialyse et Transplantation) 2025 sur la question de la faisabilité de la chirurgie bariatrique en DP.
Introduction
L'obésité représente un défi majeur de santé publique, affectant près de 40% des adultes aux États-Unis avec une prévalence identique rapportée au sein de la population atteinte d'insuffisance rénale chronique terminale (IRCT) 12.
En France, près d'un adulte sur deux présente un excès pondéral (surcharge pondérale ou obésité), dont environ 17 % d'obésité (IMC ≥ 30 kg/m²) et 2 % d'obésité sévère (IMC (indice de masse corporelle) ≥ 40 kg/m²) 3. Chez les patients atteints d'insuffisance rénale chronique terminale (IRCT), la prévalence de l'obésité est également élevée : selon les données du registre REIN, au début d'un traitement de suppléance (dialyse ou greffe), environ 23 % des hommes et 31 % des femmes sont obèses (IMC > 30). L'obésité est reconnue comme un facteur aggravant de la maladie rénale chronique et contribue à la progression vers l'IRCT. Par ailleurs, elle complique la prise en charge des patients dialysés (par exemple, en augmentant les difficultés techniques et certains risques en dialyse péritonéale). Il est donc essentiel d'optimiser la gestion pondérale à tous les stades de la maladie rénale.
Chez les patients en IRCT, l'obésité est un facteur limitant l'accès à la transplantation rénale et est associée à de moins bons résultats post-greffe avec une moins bonne survie du greffon rénal et une surmortalité 456. La chirurgie bariatrique est de plus en plus reconnue comme une stratégie efficace pour induire une perte de poids significative, améliorer les comorbidités associées (comme le diabète) et faciliter l'accès à la liste de transplantation. Dans les dernières recommandations de la HAS en 2024, la maladie rénale chronique fait partie intégrante des indications de chirurgie bariatrique, pour :
- les patients ayant un IMC compris entre 35 et 40 kg/m² associé à une maladie rénale chronique (jusqu’au stade d’IRC modérée : stade 3A et 3B) après avis du néphrologue
- les patients ayant un IMC compris entre 35 et 40 kg/m², une insuffisance rénale sévère ou terminale avec un projet de transplantation.
Cette deuxième indication, doit être discutée au cas par cas avec l’équipe de transplantation en raison du risque de morbi-mortalité et doit être réalisée dans des centres disposant d’une structure de dialyse.
Obésité et dialyse péritonéale : enjeux et impacts
Chez les patients en dialyse péritonéale, l'obésité pose plusieurs défis. Sur le plan physiopathologique, l'excès de tissu adipeux peut limiter l'efficacité des échanges péritonéaux (du fait d'un rapport poids/Surface corporelle augmenté) et accroître la pression intra-abdominale, favorisant l'apparition de complications mécaniques telles que les hernies ou les fuites de dialysat. En outre, des études suggèrent que l'obésité peut augmenter le risque de péritonite en DP : une méta-analyse de 18 études a montré une incidence significativement plus élevée de péritonites chez les patients obèses sous DP par rapport aux normo-pondéraux 7.
Indications de la chirurgie bariatrique chez le dialysé péritonéal
L'indication d'une chirurgie bariatrique chez un patient obèse en dialyse (qu'elle soit péritonéale ou hémodialyse) repose sur plusieurs considérations pronostiques. Tout d'abord, l'obésité sévère limite l'accès à la transplantation rénale : de nombreux centres fixent un seuil d'IMC (souvent 35 kg/m²) au-delà duquel l'inscription sur liste d'attente de greffe est restreinte. La chirurgie bariatrique intervient donc comme un « pont vers la greffe » : en induisant une perte pondérale importante, elle permet de ramener l'IMC du patient en deçà des seuils requis pour la transplantation, élargissant ainsi ses chances d'accès au rein greffé.
Outre la perspective de transplantation, la chirurgie bariatrique vise à améliorer l'état de santé global du patient dialysé obèse. Elle peut réduire les comorbidités liées à l'obésité (diabète de type 2, hypertension, apnée du sommeil, etc.), ce qui est particulièrement bénéfique chez des patients dont la réserve fonctionnelle est déjà diminuée par la maladie rénale terminale. Ainsi, la chirurgie bariatrique peut améliorer le pronostic des patients obèses en dialyse en augmentant leur éligibilité à la greffe et en réduisant les complications liées à l'obésité.
Il convient toutefois de sélectionner rigoureusement les candidats et de les préparer de manière optimale. Les recommandations françaises (Haute Autorité de Santé) préconisent une évaluation pluridisciplinaire approfondie avant toute chirurgie bariatrique, particulièrement chez les patients insuffisants rénaux qui sont des patients « fragiles ». Une concertation pluridisciplinaire (RCP) impliquant néphrologues, chirurgiens bariatriques, anesthésistes-réanimateurs, diététiciens, psychologues et autres spécialistes est indispensable pour peser le rapport bénéfice/risque et s'assurer de la motivation et de la capacité du patient à adhérer au suivi au long cours. Les objectifs de la chirurgie doivent être clairement définis : amélioration de la condition du patient en vue d'une transplantation, mais aussi maintien de la qualité de vie sous dialyse en attendant la greffe, avec un suivi nutritionnel étroit pour prévenir la dénutrition après la chirurgie.
Les différentes techniques de chirurgie bariatrique
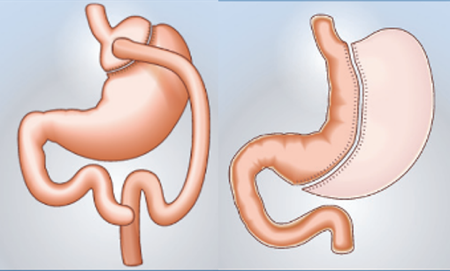
Entre 2006 et 2016 aux États-Unis, le nombre de patients atteints d’ESKD subissant une chirurgie bariatrique a été multiplié par neuf 1. Cette décennie a également été marquée par une évolution des pratiques chirurgicales : La sleeve gastrectomy (SG) est devenue la procédure de choix, devant le bypass gastrique de Roux-en-Y (RYGB). Ce changement reflète également les tendances observées dans la population générale sans ESKD aux Etats-Unis. En France, selon les données de la DREESS, le nombre de chirurgies bariatriques est également en constante augmentation ces dernières années, la plus réalisée étant également la SG [3] (Figure 1).
Figure 1.Différentes techniques de chirurgie bariatrique – HAS 2009
| Critère | Sleeve Gastrectomie | By-Pass (Roux en Y) |
| Perte de poids (1-2 ans) |
Importante – ~50–60 % en 2 ans (Technique essentiellement restrictive) |
Très importante – ~70–80 % en 2–3 ans Résultat maximal (élément malabsorptif associé). |
| Inconvénients pour les patients en DP |
Risque de RGO, Irréversible, Fuite gastrique possible |
Technique plus complexe, Risque d’ulcères anastomotiques, Rupture de la continuité digestive, Nombre plus important de trocarts, Risque plus important de malnutrition |
La Haute Autorité de Santé recommande plusieurs procédures de chirurgie bariatrique, ces données sont résumées dans le Tableau I 8. Parmi celles-ci, le bypass gastrique offre la perte de poids la plus importante et la meilleure rémission des pathologies métaboliques associées à l’obésité (diabète de type 2, hypertension artérielle, dyslipidémie, syndrome d’apnée du sommeil) 9, mais cela se fait au prix d’une complexité technique accrue et d’un risque plus élevé de complications métaboliques (hyperoxalurie, malabsorption) et de carences nutritionnelles. La sleeve gastrectomie (gastrectomie longitudinale) représente un compromis intéressant : elle permet une perte de poids significative et une amélioration des troubles métaboliques, tout en entraînant moins de complications graves qu’un bypass. Elle est cependant contre-indiquée en cas de reflux oesophagien. L’endosleeve est une technique endoscopique qui est moins efficace que la sleeve classique et plutôt réservée pour le moment aux patients ayant une contre-indication opératoire. L’anneau gastrique ajustable (LAGB) est la procédure la moins invasive, mais aussi la moins efficace en termes de perte de poids et de bénéfices métaboliques (perte de poids modeste, bénéfice métabolique limité).
Sur le plan technique, la sleeve gastrectomie (gastrectomie longitudinale) par voie coelioscopique est fréquemment privilégiée chez ces patients. Cette technique de chirurgie bariatrique consiste à retirer environ les deux tiers de l’estomac (principalement la portion fundique sécrétrice de ghréline) afin de réduire la capacité gastrique et l’appétit, sans réaliser de dérivation intestinale. La sleeve présente plusieurs avantages dans le contexte de l’IRCT : un temps opératoire généralement plus court et moins complexe qu’un bypass, pas de malabsorption induite (ce qui limite le risque de carences nutritionnelles chez des patients déjà vulnérables), souvent moins de trocarts nécessaires et un risque opératoire moindre de fistule anastomotique puisqu’il n’y a pas d’anastomose digestive. De plus la présence d’un cathéter de DP avec des adhérences peut rendre plus difficile la chirurgie en cas de bypass. Dans la littérature, la sleeve est décrite comme une option sûre et efficace chez le patient obèse dialysé, permettant d’atteindre un IMC compatible avec la greffe tout en minimisant la morbidité opératoire.
Il existe des outils pour estimer la perte de poids à partir des données cliniques du patients en fonction du type de chirurgie envisagée 10. La réalisation de ces chirurgies chez les patients en dialyse péritonéale (DP) soulève des préoccupations spécifiques : risque infectieux, fuites de dialysat, défaillance de la membrane péritonéale, et la question du maintien de la DP versus un switch temporaire vers l’hémodialyse (HD).
Pour les patients obèses en dialyse péritonéale, la chirurgie bariatrique présente également un défi unique : éviter une transition temporaire vers l’hémodialyse (HD), qui impliquerait le risque de complications liées au cathéter veineux central et aux infections.
Gestion péri-opératoire et faisabilité en dialyse péritonéale
Une série de cas canadiens, publiée en 2025 11, a rapporté rétrospectivement 11 patients en DP ayant bénéficié d’une SG pour pouvoir être candidat à une transplantation rénale. Dans cette étude, tous les patients bénéficiaient systématiquement avant la chirurgie de la pose d’un cathéter de dialyse avec un switch temporaire en hémodialyse, le temps de la cicatrisation post-opératoire. Ces résultats ont confirmé la bonne efficacité de la SG chez les patients en DP avec un BMI médian passant de 41 kg/m2 à 31 mg/m2. 80% des patients ont pu reprendre la DP après une médiane de 6 semaines de transition en hémodialyse et 70% des patients ont eu accès à une transplantation rénale au décours. En termes de complications infectieuses, on notait une bactériémie sur cathéter d’hémodialyse et une infection de liquide de DP à la reprise de la DP ayant nécessité un changement de cathéter.
En 2012, Valle et al. 12 ont rapporté les cas de 5 patients opérés par anneau gastrique ou bypass avec reprise de la DP en post-opératoire. Plusieurs case reports ont ensuite été rapportés, Imam et al. en 2013 13, Nguyen et al en 2020 14 et Van Diepen en 2023 15, avec à chaque fois une chirurgie par sleeve gastrectomy par voie laparoscopique avec une reprise précoce de la dialyse péritonéale sans switch en hémodialyse. Ces interventions ont dans tous les cas permis une amélioration rapide de l’IMC (index de masse corporelle), le risque de fuites et de complications infectieuses semblait modéré. Le protocole de gestion de la DP était souvent similaire : ventre vide le jour de la chirurgie, reprise de la dialyse péritonéale automatisée sur cycleur dès J1 avec des cycles courts (souvent 1 à 2h) à faible volume (souvent 1L), ventre vide la journée pendant 2 semaines, puis majoration progressive jusqu’à une reprise du protocole habituel à 4 semaines le plus souvent. Ce protocole semble donc surtout envisageable chez les patients ayant une diurèse conservée. Chez les patients anuriques, il conviendrait de discuter la stratégie rapportée par Ali Karam et al 11, c’est-à-dire la pose transitoire d’un cathéter tunnelisé pour une période d’hémodialyse avant de reprendre la DP après cicatrisation.
La période post-opératoire doit être l’occasion d’une surveillance rapprochée pour adapter les traitements notamment anti-hypertenseurs et le schéma de dialyse suite aux modifications induites par la chirurgie (amélioration tensionnelle, diminution des apports alimentaires, etc..).
Un point crucial du suivi post-chirurgie bariatrique chez ces patients est d’assurer le maintien d’un état nutritionnel correct. La dialyse, et particulièrement la DP, expose à des pertes protéiques et à un risque de dénutrition, qui peuvent être exacerbés par la restriction alimentaire post-chirurgicale. Il est donc impératif d’accompagner le patient avec une équipe diététique pour adapter les apports protéino-caloriques, supplémenter en vitamines et oligo-éléments si nécessaire, et surveiller l’albuminémie et l’état musculaire. Ainsi, l’objectif doit être une perte de poids maîtrisée, avec un suivi étroit, afin d’amener le patient à la transplantation dans les meilleures conditions possibles, sans compromettre sa réserve fonctionnelle par une dénutrition.
En cas d’objectif de perte de poids modérée, d’autres techniques moins invasives doivent être considérées, notamment l’endosleeve ou le traitement médical par analogues du GLP1.
Quelques case reports ont été rapportés 16 et semblent retrouver un profil de sécurité correct avec des pertes de poids efficaces. Ces traitements peuvent également être utilisés soit en alternative chez les patients non éligibles à la chirurgie, soit en complément pour stabiliser la perte pondérale postopératoire. Cependant, leur prescription chez les patients en dialyse n’est pour l’instant pas recommandée du fait d’une expérience très limitée chez ces patients.
Conclusion
L’épidémiologie de l’obésité en France, tant dans la population générale que chez les insuffisants rénaux terminaux, justifie pleinement l’attention portée à cette problématique : l’obésité touche une proportion croissante de patients dialysés, avec des implications négatives sur leur accès à la transplantation et possiblement sur l’évolution de leur maladie rénale.
La chirurgie bariatrique semble possible et sûre chez les patients en dialyse péritonéale, à condition d’une étroite collaboration entre néphrologues, chirurgiens bariatriques et équipes de DP. La sleeve gastrectomy apparaît aujourd’hui comme la meilleure option : efficace sur la perte de poids, techniquement réalisable par laparoscopie, et compatible avec la poursuite ou la reprise rapide de la DP sans recours systématique à l’hémodialyse. Elle permet une perte pondérale significative, améliorant ainsi l’accessibilité à la greffe rénale et, de ce fait, la survie à long terme comparativement au maintien en dialyse sans chirurgie. Le risque de complications post-opératoires et infectieuses semble comparable à celui de la population générale. Il convient cependant d’être particulièrement vigilant au risque de sarcopénie chez ces patients. Chaque cas doit bien sûr faire l’objet d’une évaluation individualisée en RCP, en tenant compte du profil de risque chirurgical, du statut nutritionnel, du support social et de la motivation du patient. Le succès de cette approche repose sur une prise en charge multidisciplinaire intégrée : collaboration entre néphrologues, chirurgiens bariatriques, nutritionnistes et autres spécialistes tout au long du parcours pré- et post-opératoire. L’objectif principal reste l’accès à la transplantation rénale, mais ces interventions améliorent également le contrôle métabolique, la qualité de vie et la tolérance de la dialyse.
Contributions des auteurs
VF et GB ont rédigé l’article, et MFE, CL et TL l’ont relu et ont apporté des commentaires et des corrections.
Considérations éthiques et consentement patient
Sans objetDisponibilité des données
Sans objet
Financement
Les auteurs n'ont reçu aucun financement pour ce travail
Conflits d’intérêts
Les auteurs déclarent n'avoir aucun conflit d'intérêts.
ORCID iDs
Victor Fages : https://orcid.org/0000-0002-1722-9042
Grégory Baud : https://orcid.org/0000-0001-7130-7315
Marion Féricot : https://orcid.org/0009-0009-1006-2225
Célia Lessore : https://orcid.org/0009-0008-9767-5704
Thierry Lobbedez : https://orcid.org/0000-0003-2914-6786
Références
- Sheetz K.H., Gerhardinger L., Dimick J.B., Waits S.A.. Bariatric Surgery and Long-term Survival in Patients With Obesity and End-stage Kidney Disease. JAMA Surg. 2020. DOI
- MD1,2. Population-based Trends in Obesity and Kidney Transplantation Among Patients With End-stage Kidney Disease. Transplantation Direct. 2021; 7(12)DOI
- Fontbonne A., Currie A., Tounian P., Picot M.C., Foulatier O., Nedelcu M., Nocca D.. Prevalence of Overweight and Obesity in France: The 2020 Obepi-Roche Study by the «Ligue Contre l’Obésité». J Clin Med. 2023. DOI
- Segev D.L., Simpkins C.E., Thompson R.E., Locke J.E., Warren D.S., Montgomery R.A.. Obesity impacts access to kidney transplantation. J Am Soc Nephrol. 2008; Feb;19(2):349-55DOI
- Hill C.J., Courtney A.E., Cardwell C.R., Maxwell A.P., Lucarelli G., Veroux M., Furriel F., Cannon R.M., Hoogeveen E.K., Doshi M., McCaughan J.A.. Recipient obesity and outcomes after kidney transplantation: a systematic review and meta-analysis. Nephrol Dial Transplant. 2015; Aug;30(8):1403-11DOI
- Meier-Kriesche H.U., Arndorfer J.A., Kaplan B.. The impact of body mass index on renal transplant outcomes: a significant independent risk factor for graft failure and patient death. Transplantation. 2002. DOI
- Chen X., Mao Y., Ge Y.. Does Body Mass Index Impact the Outcomes of Peritoneal Dialysis Patients? A Systematic Review and Meta-Analysis of Non-Randomized Trials. Obes Facts. 2025. DOI
- P Courcoulas A., R Daigle C., E Arterburn D.. Long term outcomes of metabolic/bariatric surgery in adults BMJ. 2023. DOI
- Queiroz S., Gadelha J.G., Husain N., Gutu C.S.. Effect of Gastric Bypass vs Sleeve Gastrectomy on Remission of Type 2 Diabetes Mellitus Among Patients with Severe Obesity: A Meta-Analysis. Obes Surg. 2025. DOI
- Development and validation of an interpretable machine learning-based calculator for predicting 5-year weight trajectories after bariatric surgery: a multinational retrospective cohort SOPHIA study. Saux, Patrick et al.The Lancet Digital Health. 5(ue 10):692-702.
- Karam A.A., Safar A., Vourtzoumis P., Demyttenaere S., Court O., Andalib A.. How to manage peritoneal dialysis in patients undergoing bariatric surgery? A case series from a single academic center. Surg Endosc. 2025. DOI
- Valle G.A., Kissane B.E., Cruz-Muñoz N.. Successful laparoscopic bariatric surgery in peritoneal dialysis patients without interruption of their CKD6 treatment modality. Adv Perit Dial. 2012; 28(134-9)
- Imam T.H., Wang J., Khayat F.S.. Bariatric Surgery in a Patient on Peritoneal Dialysis. Peritoneal dialysis international : journal of the International Society for Peritoneal Dialysis. 2013; 33:710-711.
- Nguyen A.H., Naljayan M., Yazdi F., Reisin E.. Laparoscopic Sleeve Gastrectomy in a Patient on Peritoneal Dialysis. Kidney Int Rep. 2020; 3;5(12):2361-2364DOI
- Diepen ATW Vening, Meulen RCJC Verhave. Avoiding interim haemodialysis by early restart of peritoneal dialysis following sleeve gastrectomy for obesity. Peritoneal Dialysis International: Journal of the International Society for Peritoneal Dialysis. 2023; 43(4):345-347. DOI
- Yavorskiy P., Borrelli S., Esposito K., Maiorino M.I., Petrizzo M., Nicola L., Garofalo C.. Lesson for the clinical nephrologist: glucagon-like peptide-1 receptor agonists (GLP-1 RA) in a patient with obesity and diabetic kidney disease on peritoneal dialysis. J Nephrol. 2025. DOI
Références
1) Sheetz KH, Gerhardinger L, Dimick JB, Waits SA. Bariatric Surgery and Long-term Survival in Patients With Obesity and End-stage Kidney Disease. JAMA Surg. 2020 Jul 1;155(7):581-588. doi: https://doi.org/10.1001/jamasurg.2020.0829.
2) Wakam, Glenn K. MD1; Sheetz, Kyle H. MD, MS1,2; Gerhardinger, Laura MA2; Montgomery, John R. MD1,2; Waits, Seth A. MD1,2. Population-based Trends in Obesity and Kidney Transplantation Among Patients With End-stage Kidney Disease. Transplantation Direct 7(12):p e787, December 2021. | doi: https://doi.org/10.1097/txd.0000000000001163
3) Fontbonne A, Currie A, Tounian P, Picot MC, Foulatier O, Nedelcu M, Nocca D. Prevalence of Overweight and Obesity in France: The 2020 Obepi-Roche Study by the «Ligue Contre l’Obésité». J Clin Med. 2023 Jan 25;12(3):925. doi: https://doi.org/10.3390/jcm12030925.
4) Segev DL, Simpkins CE, Thompson RE, Locke JE, Warren DS, Montgomery RA. Obesity impacts access to kidney transplantation. J Am Soc Nephrol. 2008 Feb;19(2):349-55. doi: https://doi.org/10.1681/asn.2007050610. Epub 2007 Dec 19.
5) Hill CJ, Courtney AE, Cardwell CR, Maxwell AP, Lucarelli G, Veroux M, Furriel F, Cannon RM, Hoogeveen EK, Doshi M, McCaughan JA. Recipient obesity and outcomes after kidney transplantation: a systematic review and meta-analysis. Nephrol Dial Transplant. 2015 Aug;30(8):1403-11. doi: https://doi.org/10.1093/ndt/gfv214. Epub 2015 Jun 4.
6) Meier-Kriesche HU, Arndorfer JA, Kaplan B. The impact of body mass index on renal transplant outcomes: a significant independent risk factor for graft failure and patient death. Transplantation. 2002 Jan 15;73(1):70-4. doi: https://doi.org/10.1097/00007890-200201150-00013.
7) Chen X, Mao Y, Ge Y. Does Body Mass Index Impact the Outcomes of Peritoneal Dialysis Patients? A Systematic Review and Meta-Analysis of Non-Randomized Trials. Obes Facts. 2025 Oct 16:1-20. doi: https://doi.org/10.1159/000548725. Epub ahead of print.
8) Courcoulas A P, Daigle C R, Arterburn D E. Long term outcomes of metabolic/bariatric surgery in adults BMJ 2023; 383 :e071027 doi: https://doi.org/10.1136/bmj-2022-071027
9) Queiroz S, Gadelha JG, Husain N, Gutu CS. Effect of Gastric Bypass vs Sleeve Gastrectomy on Remission of Type 2 Diabetes Mellitus Among Patients with Severe Obesity: A Meta-Analysis. Obes Surg. 2025 Jun;35(6):2296-2302. doi: https://doi.org/10.1007/s11695-025-07858-w. Epub 2025 May 16.
10) Development and validation of an interpretable machine learning-based calculator for predicting 5-year weight trajectories after bariatric surgery: a multinational retrospective cohort SOPHIA study. Saux, Patrick et al.The Lancet Digital Health, Volume 5, Issue 10, e692 - e702
11) Karam AA, Safar A, Vourtzoumis P, Demyttenaere S, Court O, Andalib A. How to manage peritoneal dialysis in patients undergoing bariatric surgery? A case series from a single academic center. Surg Endosc. 2025 Jul;39(7):4479-4485. doi: https://doi.org/10.1007/s00464-025-11800-7. Epub 2025 May 19. PMID: 40389654.
12) Valle GA, Kissane BE, de la Cruz-Muñoz N. Successful laparoscopic bariatric surgery in peritoneal dialysis patients without interruption of their CKD6 treatment modality. Adv Perit Dial. 2012;28:134-9. PMID: 23311230.
13) Imam, T.H. & Wang, J & Khayat, F.S.. (2013). Bariatric Surgery in a Patient on Peritoneal Dialysis. Peritoneal dialysis international : journal of the International Society for Peritoneal Dialysis. 33. 710-711. 10.3747/pdi.2012.00272.
14) Nguyen AH, Naljayan M, Yazdi F, Reisin E. Laparoscopic Sleeve Gastrectomy in a Patient on Peritoneal Dialysis. Kidney Int Rep. 2020 Oct 3;5(12):2361-2364. doi: https://doi.org/10.1016/j.ekir.2020.09.014. PMID: 33305132; PMCID: PMC7710827.
15) Van Diepen AT, Vening W, ter Meulen RC, Verhave JC. Avoiding interim haemodialysis by early restart of peritoneal dialysis following sleeve gastrectomy for obesity. Peritoneal Dialysis International: Journal of the International Society for Peritoneal Dialysis. 2023;43(4):345-347. doi: https://doi.org/10.1177/08968608231167246
16) Yavorskiy P, Borrelli S, Esposito K, Maiorino MI, Petrizzo M, De Nicola L, Garofalo C. Lesson for the clinical nephrologist: glucagon-like peptide-1 receptor agonists (GLP-1 RA) in a patient with obesity and diabetic kidney disease on peritoneal dialysis. J Nephrol. 2025 Apr;38(3):1123-1125. doi: https://doi.org/10.1007/s40620-025-02247-z.
Téléchargements
Soumis
Accepté
Publié
Comment citer
Numéro
Rubrique
Licence
© Victor Fages, Gregory Baud, Marion Fericot, Célia LESSORE, Thierry Lobbedez 2025

Ce travail est disponible sous la licence Creative Commons Attribution 4.0 International .










